Contacto: joseimery@gmail.com
BANDEO CROMOSÓMICO DE FLUORESCENCIA EN Aloe L. (Aloaceae)
FLUORESCENT CHROMOSOME BANDING IN Aloe L. (Aloaceae)
SÁNCHEZ YSBELIA*, M. CRISTINA ACOSTA**, MARÍA B. RAYMÚNDEZ*, JOSÉ IMERY*, EDUARDO A. MOSCONE**.
*Laboratorio de Biosistemática y Citogenética Vegetal, Instituto de Biología Experimental (IBE), Universidad Central de Venezuela, Calle Suapure, Colinas de Bello Monte, Caracas, Venezuela; ysbe1576@yahoo.es.
** Laboratorio de Citogenética, Instituto Multidisciplinario de Biología Vegetal (IMBIV), Universidad Nacional de Córdoba-CONICET, Casilla de Correo 495, 5000Córdoba, Argentina. moscone@imbiv.unc.edu.ar
RESUMEN
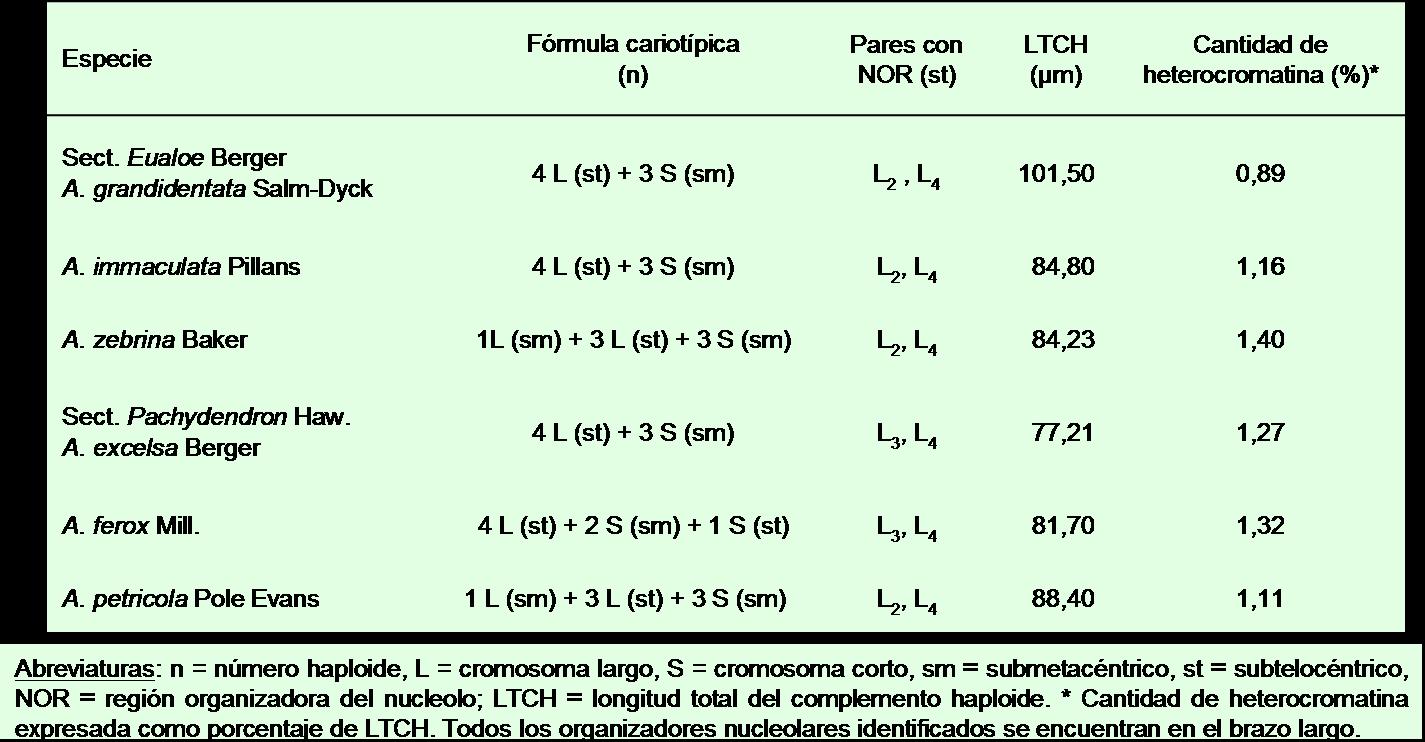
Se analizan por primera vez con bandeo de fluorescencia los cromosomas somáticos de seis especies pertenecientes a dos secciones de Aloe, aportándose datos cariotípicos preliminares. Todas las entidades tienen 2n=2x=14 y dos pares de cromosomas portan regiones organizadoras nucleolares con satélites asociados. La heterocromatina constitutiva es siempre CMA+ DAPI– (ricas en nucleótidos G-C) y en todos los casos es subterminal asociándose a las NORs (constricción secundaria más regiones adyacentes del brazo correspondiente y del satélite asociado). La cantidad de heterocromatina (expresada en % de la longitud del cariotipo) varía poco entre las especies – Sect. Eualoe: A. grandidentata (0,89), A. immaculata (1,16) y A. zebrina (1,40); Sect. Pachydendron: A. excelsa (1,27), A. ferox (1,32) y A. petricola (1,11) – y el patrón de bandeo es constante. La heterocigosis estructural en el patrón de bandeo fluorescente se limita a la ausencia de banda en uno de los miembros del par L2 en A. petricola. Los resultados obtenidos no permiten separar citológicamente a ambas secciones y corroboran la ortoselección cariotípica reportada para el género.
PALABRAS CLAVE Aloaceae, Aloe, cariosistemática, bandeo de fluorescencia, heterocromatina, evolución cromosómica.
INTRODUCCIÓN
Aloe, ubicado en la familia Aloaceae junto a Haworthia Duval y Gasteria Duval, está constituido por unas 400 especies, algunas de ellas (eg. A. vera L.) de gran importancia económica por su alto contenido de aloína, sustancia con propiedades medicinales y de amplio uso farmacológico (Holland, 1978; Cronquist, 1981). La mayoría de sus integrantes son diploides (2n = 2x = 14), citándose algunos tetraploides y un hexaploide. Tanto en Aloe como en los restantes géneros de la familia se presenta un cariotipo básico bimodal muy estable, con cuatro cromosomas grandes (L1 – L4) y tres pequeños (S1 – S3), fenómeno que indica una fuerte ortoselección cariotípica (cf. Brandham, 1971; Brandham & Doherty, 1998).
Si bien hay numerosas contribuciones sobre la cariología de Aloe con métodos de tinción clásica, los estudios cromosómicos con técnicas de bandeo se limitan a A. vera, donde sólo se aplicó bandeo C para detectar la orientación de los cromosomas en interfase (Ghosh & Satyesh, 1977) y bandeo AgNOR para localizar las regiones organizadoras del nucleolo activas (Matos et al., 1998). En el presente trabajo se examinan por primera vez mediante bandeo de fluorescencia metafases somáticas y núcleos interfásicos de seis especies originarias de África (Holland, 1978), que pertenecen a dos secciones (cfr. Tabla 1), con el fin de aportar datos útiles para su caracterización citogenética y arrojar luz sobre sus relaciones sistemáticas y evolutivas.
MATERIALES Y MÉTODOS
El material de Aloe examinado (Tabla 1) se obtuvo de “Mesa Garden” (Méjico), “Le Jardin Naturel” (Francia) y viveros comerciales de Venezuela. Las plantas fueron cultivadas bajo condiciones de invernadero en el Departamento de Biología de la Universidad de Oriente, Cumaná, Venezuela. Se colectaron ápices radicales que fueron pretratados con colchicina (Imery & Caldera, 2002) y posteriormente fijados en solución Farmer. Las preparaciones cromosómicas se realizaron por aplastamiento previa maceración con solución enzimática (Schwarzacher et al., 1980). Se aplicó la tinción triple con los fluorocromos cromomicina A3, distamicina A y 4'-6-diamidino-2-fenilindol (CMA/DA/DAPI), según Schweizer (1980). Los cromosomas fueron observados y fotografiados en un microscopio de epifluorescencia Leica DMLB equipado con una cámara digital Leica DC 250 y el analizador de imágenes Leica IM 1000. Se efectuaron mediciones cromosómicas en placas metafásicas correspondientes a un individuo de cada especie. Para la descripción y ordenamiento de los cromosomas se empleó la nomenclatura de Levan et al. (1964) y Brandham (1971).
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se detallan los resultados obtenidos en las seis especies de Aloe consideradas. Cabe señalar que el cariotipo de las entidades aquí analizadas solo había sido estudiado con anterioridad mediante tinción convencional (Brandham, 1971; etc.), constituyendo éste el primer análisis con métodos de bandeo.
Salvo algunas diferencias en la morfología cromosómica, los cariotipos son similares. Así, A. grandidentata, A. immaculata y A. excelsa presentan la misma fórmula cariotípica, al igual que A. petricola y A. zebrina. Todas las especies muestran dos pares de NORs en la misma posición, excepto A. excelsa y A. ferox donde un par se ubica en L3 en vez de L2. Aloe grandidentata se distingue de las restantes entidades por su genoma más grande, mientras que A. excelsa tiene el más pequeño.
La heterocromatina constitutiva es siempre CMA+ DAPI–, indicativa de DNA satélite rico en pares de nucleótidos G-C (Schweizer, 1980), y en todos los casos es subterminal asociándose a las NORs (constricción secundaria más regiones adyacentes del brazo correspondiente y del satélite asociado). La cantidad de heterocromatina (expresada en % de la longitud del cariotipo) varía muy poco entre las especies, en un rango de 0,89–1,40, y el patrón de bandeo es constante. En todos los taxones se encontró correlación entre el número y el tamaño de los cromocentros en los núcleos interfásicos con respecto a las bandas heterocromáticas en los cromosomas metafásicos. Se registró escasa heterocigosis estructural en el patrón de bandeo heterocromático entre cromosomas homólogos, i.e., la ausencia de banda en uno de los miembros del par L2 en A. petricola.
Los datos obtenidos, que se consideran preliminares, no permiten separar citológicamente a ambas secciones y corroboran
a fuerte presión selectiva existente en el género en contra de los cambios cariotípicos (Brandham & Doherty, 1998).
FLUORESCENT CHROMOSOME BANDING IN Aloe L. (Aloaceae)
SÁNCHEZ YSBELIA*, M. CRISTINA ACOSTA**, MARÍA B. RAYMÚNDEZ*, JOSÉ IMERY*, EDUARDO A. MOSCONE**.
*Laboratorio de Biosistemática y Citogenética Vegetal, Instituto de Biología Experimental (IBE), Universidad Central de Venezuela, Calle Suapure, Colinas de Bello Monte, Caracas, Venezuela; ysbe1576@yahoo.es.
** Laboratorio de Citogenética, Instituto Multidisciplinario de Biología Vegetal (IMBIV), Universidad Nacional de Córdoba-CONICET, Casilla de Correo 495, 5000Córdoba, Argentina. moscone@imbiv.unc.edu.ar
RESUMEN
Se analizan por primera vez con bandeo de fluorescencia los cromosomas somáticos de seis especies pertenecientes a dos secciones de Aloe, aportándose datos cariotípicos preliminares. Todas las entidades tienen 2n=2x=14 y dos pares de cromosomas portan regiones organizadoras nucleolares con satélites asociados. La heterocromatina constitutiva es siempre CMA+ DAPI– (ricas en nucleótidos G-C) y en todos los casos es subterminal asociándose a las NORs (constricción secundaria más regiones adyacentes del brazo correspondiente y del satélite asociado). La cantidad de heterocromatina (expresada en % de la longitud del cariotipo) varía poco entre las especies – Sect. Eualoe: A. grandidentata (0,89), A. immaculata (1,16) y A. zebrina (1,40); Sect. Pachydendron: A. excelsa (1,27), A. ferox (1,32) y A. petricola (1,11) – y el patrón de bandeo es constante. La heterocigosis estructural en el patrón de bandeo fluorescente se limita a la ausencia de banda en uno de los miembros del par L2 en A. petricola. Los resultados obtenidos no permiten separar citológicamente a ambas secciones y corroboran la ortoselección cariotípica reportada para el género.
PALABRAS CLAVE Aloaceae, Aloe, cariosistemática, bandeo de fluorescencia, heterocromatina, evolución cromosómica.
INTRODUCCIÓN
Aloe, ubicado en la familia Aloaceae junto a Haworthia Duval y Gasteria Duval, está constituido por unas 400 especies, algunas de ellas (eg. A. vera L.) de gran importancia económica por su alto contenido de aloína, sustancia con propiedades medicinales y de amplio uso farmacológico (Holland, 1978; Cronquist, 1981). La mayoría de sus integrantes son diploides (2n = 2x = 14), citándose algunos tetraploides y un hexaploide. Tanto en Aloe como en los restantes géneros de la familia se presenta un cariotipo básico bimodal muy estable, con cuatro cromosomas grandes (L1 – L4) y tres pequeños (S1 – S3), fenómeno que indica una fuerte ortoselección cariotípica (cf. Brandham, 1971; Brandham & Doherty, 1998).
Si bien hay numerosas contribuciones sobre la cariología de Aloe con métodos de tinción clásica, los estudios cromosómicos con técnicas de bandeo se limitan a A. vera, donde sólo se aplicó bandeo C para detectar la orientación de los cromosomas en interfase (Ghosh & Satyesh, 1977) y bandeo AgNOR para localizar las regiones organizadoras del nucleolo activas (Matos et al., 1998). En el presente trabajo se examinan por primera vez mediante bandeo de fluorescencia metafases somáticas y núcleos interfásicos de seis especies originarias de África (Holland, 1978), que pertenecen a dos secciones (cfr. Tabla 1), con el fin de aportar datos útiles para su caracterización citogenética y arrojar luz sobre sus relaciones sistemáticas y evolutivas.
MATERIALES Y MÉTODOS
El material de Aloe examinado (Tabla 1) se obtuvo de “Mesa Garden” (Méjico), “Le Jardin Naturel” (Francia) y viveros comerciales de Venezuela. Las plantas fueron cultivadas bajo condiciones de invernadero en el Departamento de Biología de la Universidad de Oriente, Cumaná, Venezuela. Se colectaron ápices radicales que fueron pretratados con colchicina (Imery & Caldera, 2002) y posteriormente fijados en solución Farmer. Las preparaciones cromosómicas se realizaron por aplastamiento previa maceración con solución enzimática (Schwarzacher et al., 1980). Se aplicó la tinción triple con los fluorocromos cromomicina A3, distamicina A y 4'-6-diamidino-2-fenilindol (CMA/DA/DAPI), según Schweizer (1980). Los cromosomas fueron observados y fotografiados en un microscopio de epifluorescencia Leica DMLB equipado con una cámara digital Leica DC 250 y el analizador de imágenes Leica IM 1000. Se efectuaron mediciones cromosómicas en placas metafásicas correspondientes a un individuo de cada especie. Para la descripción y ordenamiento de los cromosomas se empleó la nomenclatura de Levan et al. (1964) y Brandham (1971).
RESULTADOS Y DISCUSIÓN
En la Tabla 1 se detallan los resultados obtenidos en las seis especies de Aloe consideradas. Cabe señalar que el cariotipo de las entidades aquí analizadas solo había sido estudiado con anterioridad mediante tinción convencional (Brandham, 1971; etc.), constituyendo éste el primer análisis con métodos de bandeo.
Salvo algunas diferencias en la morfología cromosómica, los cariotipos son similares. Así, A. grandidentata, A. immaculata y A. excelsa presentan la misma fórmula cariotípica, al igual que A. petricola y A. zebrina. Todas las especies muestran dos pares de NORs en la misma posición, excepto A. excelsa y A. ferox donde un par se ubica en L3 en vez de L2. Aloe grandidentata se distingue de las restantes entidades por su genoma más grande, mientras que A. excelsa tiene el más pequeño.
La heterocromatina constitutiva es siempre CMA+ DAPI–, indicativa de DNA satélite rico en pares de nucleótidos G-C (Schweizer, 1980), y en todos los casos es subterminal asociándose a las NORs (constricción secundaria más regiones adyacentes del brazo correspondiente y del satélite asociado). La cantidad de heterocromatina (expresada en % de la longitud del cariotipo) varía muy poco entre las especies, en un rango de 0,89–1,40, y el patrón de bandeo es constante. En todos los taxones se encontró correlación entre el número y el tamaño de los cromocentros en los núcleos interfásicos con respecto a las bandas heterocromáticas en los cromosomas metafásicos. Se registró escasa heterocigosis estructural en el patrón de bandeo heterocromático entre cromosomas homólogos, i.e., la ausencia de banda en uno de los miembros del par L2 en A. petricola.
Los datos obtenidos, que se consideran preliminares, no permiten separar citológicamente a ambas secciones y corroboran
a fuerte presión selectiva existente en el género en contra de los cambios cariotípicos (Brandham & Doherty, 1998).
REFERENCIAS
BRANDHAM P. E. 1971. The Chromosome of the Liliaceae: III. New cases of interchange hybridity in the Aloineae. Kew Bull. 28:341-349.
BRANDHAM P. E. & DOHERTY M. J. 1998. Genome size variation in the Aloaceae, an angiosperm family displaying karyotypic orthoselection. Ann. Bot. 82(Suppl. A):67-73.
CRONQUIST A. 1981. An Integrated System of Classification of Flowering Plants. Columbia University Press, New York, USA. pp.1262.
GHOSH S. & SATYESH C. 1977. Orientation of interphase chromosome as detected by Giemsa C -bands. Chromosoma 61:49-55.
HOLLAND P. G. 1978. An evolutionary biogeography of the genus Aloe. J. Biogeogr. 5:213-226.
IMERY J. & CALDERA T. 2002. Estudio cromosómico comparativo de cinco especies de Aloe (Aloaceae). Acta Bot. Venez. 25:47-66.
LEVAN A., FREDGA K. & SANDBERG A. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52:201-220.
MATOS A., MOLINA J. & ACOSTA D. 1998. Localización de NORs en cromosomas de Aloe vera L. (Aloaceae). Acta Bot. Venez. 21:1-9.
SCHWARZACHER T., AMBROS P. & SCHWEIZER D. 1980. Application of Giemsa banding to orchid karyotype analysis. Pl. Syst. Evol. 134:293-297.
SCHWEIZER D. 1980. Simultaneous fluorescent staining of R bands and specific heterochromatic regions (DA–DAPI) in human chromosomes. Cytogenet. Cell Genet. 27:190-193.
AGRADECIMIENTO
Y.S. Agradece la beca de FONACIT (Venezuela) para una estadía en el Laboratorio de Citogenética del IMBIV (Córdoba, Argentina). Este trabajo recibió el apoyo económico de la SECYT (Universidad Nacional de Córdoba), mediante subsidio otorgado a E.A.M.
BRANDHAM P. E. 1971. The Chromosome of the Liliaceae: III. New cases of interchange hybridity in the Aloineae. Kew Bull. 28:341-349.
BRANDHAM P. E. & DOHERTY M. J. 1998. Genome size variation in the Aloaceae, an angiosperm family displaying karyotypic orthoselection. Ann. Bot. 82(Suppl. A):67-73.
CRONQUIST A. 1981. An Integrated System of Classification of Flowering Plants. Columbia University Press, New York, USA. pp.1262.
GHOSH S. & SATYESH C. 1977. Orientation of interphase chromosome as detected by Giemsa C -bands. Chromosoma 61:49-55.
HOLLAND P. G. 1978. An evolutionary biogeography of the genus Aloe. J. Biogeogr. 5:213-226.
IMERY J. & CALDERA T. 2002. Estudio cromosómico comparativo de cinco especies de Aloe (Aloaceae). Acta Bot. Venez. 25:47-66.
LEVAN A., FREDGA K. & SANDBERG A. 1964. Nomenclature for centromeric position on chromosomes. Hereditas 52:201-220.
MATOS A., MOLINA J. & ACOSTA D. 1998. Localización de NORs en cromosomas de Aloe vera L. (Aloaceae). Acta Bot. Venez. 21:1-9.
SCHWARZACHER T., AMBROS P. & SCHWEIZER D. 1980. Application of Giemsa banding to orchid karyotype analysis. Pl. Syst. Evol. 134:293-297.
SCHWEIZER D. 1980. Simultaneous fluorescent staining of R bands and specific heterochromatic regions (DA–DAPI) in human chromosomes. Cytogenet. Cell Genet. 27:190-193.
AGRADECIMIENTO
Y.S. Agradece la beca de FONACIT (Venezuela) para una estadía en el Laboratorio de Citogenética del IMBIV (Córdoba, Argentina). Este trabajo recibió el apoyo económico de la SECYT (Universidad Nacional de Córdoba), mediante subsidio otorgado a E.A.M.
Tabla 1.Caracteres cariotípicos de seis especies de Aloe, todas con 2n = 14